芯片资讯
- 发布日期:2024-01-17 08:11 点击次数:140
癌症作为全球第二大死因,每年导致约1千万人死亡。循环肿瘤细胞(CTCs)是指从原发肿瘤病灶脱落并进入外周血液循环的各类肿瘤细胞,被认为是癌症转移的重要标志物。CTCs在肿瘤早期就已出现,并携带肿瘤大量的实时信息,因此CTCs检测在癌症研究中受到了越来越广泛的关注。然而,由于血液中CTCs数量极少,1mL全血中仅含有1 ~ 10个CTCs,高效分离并准确测定全血样品中的CTCs存在巨大困难。近年来,微流控芯片技术已发展成为一种极具潜力的从血液中分选富集CTCs的技术。CTCs分选性能在很大程度上取决于芯片的设计,因此,设计并搭建分选性能优异、操作简便的微流控芯片平台至关重要。
近期,武汉大学胡斌教授课题组报道了一种基于磁性探针的级联相转移多功能微流控芯片平台,通过与电感耦合等离子体质谱(ICP-MS)联用,成功实现CTCs的高活性分选、纯化、释放和定量检测,相关成果以“ACascaded Phase-Transfer Microfluidic Chip with Magnetic Probe for High-ActivitySorting, Purification, Release, and Detection of Circulating Tumor Cells”为题发表在国际化学权威杂志AnalyticalChemistry上。
研究人员构建了一个多功能级联相转移微流控芯片平台,该芯片集被动分选和主动分选于一体,主要由分选区、纯化区和释放区三个功能区组成。实验原理如图1所示,CTCs在微流控芯片中经历分选、纯化和释放,之后引入ICP-MS检测实现对其的准确定量。首先,将EpCAM适配体修饰的磁球与去除红细胞的血液样品共孵育一段时间,实现磁性探针对CTCs的识别和捕获,随后将其从入口样品处引入芯片。在细胞分选区域,CTCs在中心强磁场和螺旋通道的共同作用下,迅速从宽分布状迁移至通道内壁,并沿着内侧从第一个分选口处进入细胞纯化区,此时大量血细胞则从出口1流出,实现CTCs的初步分选。同时,另一入口通入的PBS缓冲液将与进入纯化区的CTCs样品流形成稳定的层流,CTCs在磁力和流体动力的共同作用下,从样品流相转移至PBS缓冲液中,而剩余血细胞则保持在原样品流中从出口2流出,完成CTCs的进一步纯化。核酸酶溶液从核酸酶入口处通入,与含有CTCs的PBS流在释放区形成稳定的层流。在锯齿状的芯片结构和矩形磁铁的磁场作用下,CTCs再次相转移至酶溶液中,并在强磁场作用下被固定在锯齿凹槽内。此时,持续流动的酶溶液不断酶解磁球与细胞之间连接的适配体,最终磁球留在锯齿凹槽内,而细胞从磁球上脱离后则随酶溶液从出口3流出,实现温和的CTCs释放。将CTCs收集,可用于后续ICP-MS定量检测或再培养等下游分析。
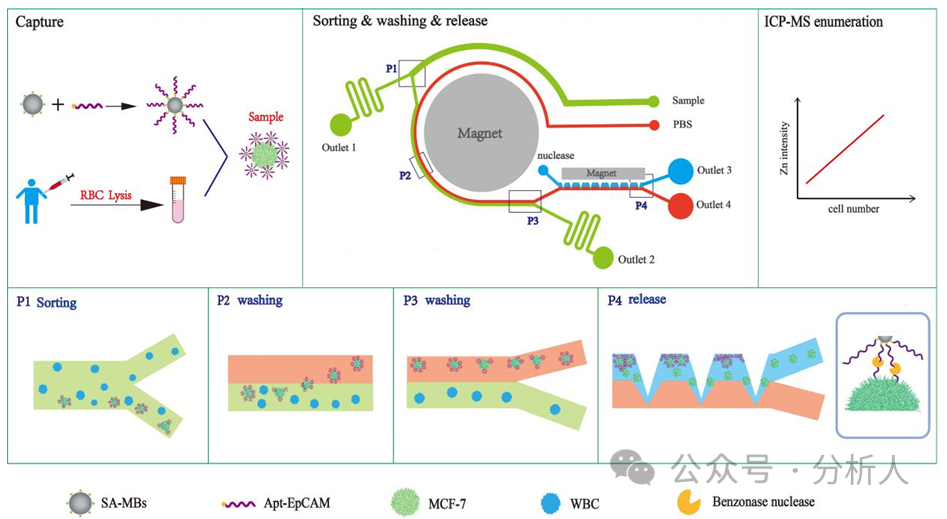 图1 级联相转移多功能微流控芯片的设计及CTCs捕获、分选、纯化、释放和ICP-MS检测原理图
图1 级联相转移多功能微流控芯片的设计及CTCs捕获、分选、纯化、释放和ICP-MS检测原理图
随后,研究人员分别考察了CTCs分选纯化区芯片和CTCs释放区芯片的可行性。将磁性探针结合的CTCs和含有红色墨水的PBS缓冲液分别引入分选纯化区芯片,并在显微镜下观察细胞在芯片中的迁移,结果如图2A ~ 2C所示。在第一个分选口处、相转移过程中和第二个分选口处,均能观察到CTCs沿着预设的路径发生转移,并最终从目标出口流出, 亿配芯城 表明分选纯化区的设计可行。同样地,将磁性探针结合的且Hoechst预染色的CTCs和核酸酶溶液分别从两个入口引入释放区芯片,如图2D ~ 2G所示,可以观察到凹槽内的CTCs先迅速积累,随后逐渐被释放,且目标出口所收集到的CTCs表面并未观察到明显的磁性颗粒,表明芯片释放区可以成功实现CTCs的转移、固定和释放。
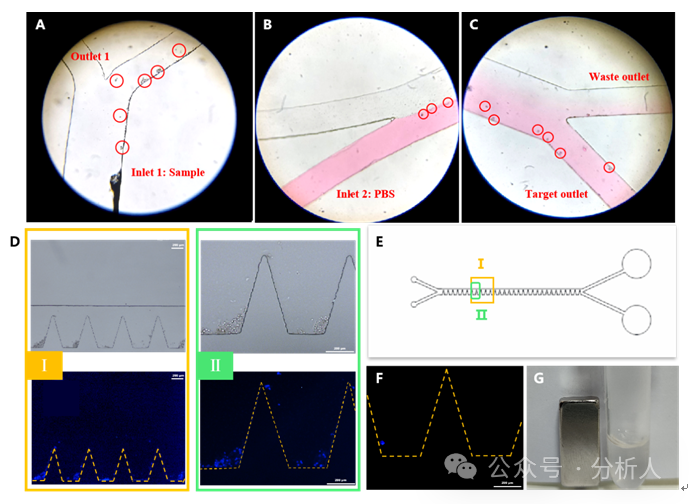 图2 细胞分选和释放的可行性
图2 细胞分选和释放的可行性
接着,研究人员对一系列实验条件进行了优化。在最优的条件下,细胞捕获、分选和释放效率分别为84%、89%和94%(图3A)。此外,研究人员考察了方法在PBS和血浆基质中对CTCs的回收率,从图3B可以看出,不同密度CTCs下,两种基质中的细胞回收率都相对稳定且保持较高水平(75% ~ 80%),展现了该方法较强的抗基质干扰能力。通过AO/EB双染实验进一步考察了所回收CTCs的细胞活性,存活率高达99.3%。随后,研究人员探究了该方法的特异性,如图4所示,结果表明本方法对EpCAM表达阳性的细胞具有良好的特异性,同时对EpCAM表达阴性的细胞具有较强的抵抗力。
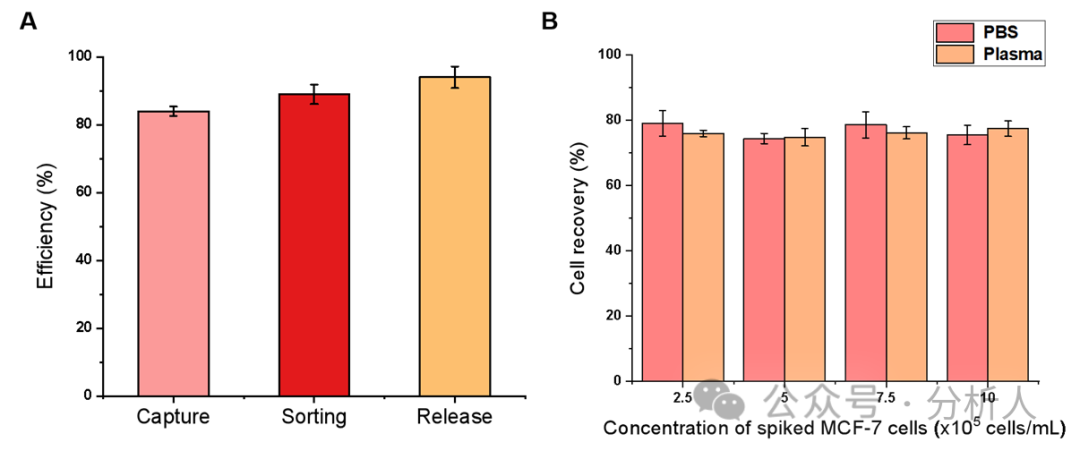 图3 (A)最佳条件下MCF-7细胞在PBS中的细胞捕获、分选和释放效率;(B)不同密度MCF-7细胞在PBS和血浆中的细胞回收率
图3 (A)最佳条件下MCF-7细胞在PBS中的细胞捕获、分选和释放效率;(B)不同密度MCF-7细胞在PBS和血浆中的细胞回收率
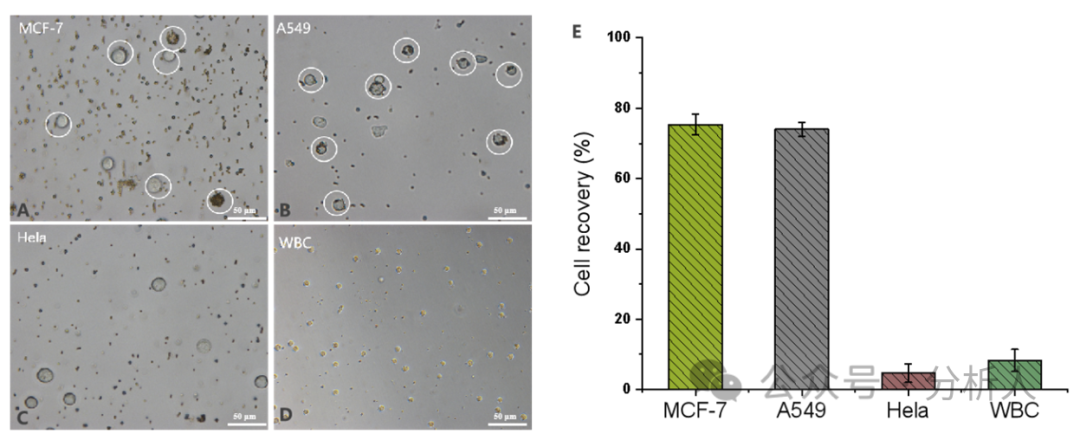 图4 方法特异性
为了验证该方法在实际血样中的分析能力,在实际血样中加标不同数量的MCF-7细胞,采用本方法测定了加标血样中MCF-7细胞的个数。从图5A中可以看到,检测到的MCF-7细胞的个数与加标的MCF-7细胞的个数呈较好的相关性,表明该方法具备良好的临床应用潜力。最后,将所构建的方法用于16名乳腺癌患者和4名健康人全血样本检测。如图5B ~ 5C所示,在16例患者中,CTCs均有检出(6 ~ 241个/mL),且明显高于健康人血液中的平均CTCs个数(0.5个/mL)。
图4 方法特异性
为了验证该方法在实际血样中的分析能力,在实际血样中加标不同数量的MCF-7细胞,采用本方法测定了加标血样中MCF-7细胞的个数。从图5A中可以看到,检测到的MCF-7细胞的个数与加标的MCF-7细胞的个数呈较好的相关性,表明该方法具备良好的临床应用潜力。最后,将所构建的方法用于16名乳腺癌患者和4名健康人全血样本检测。如图5B ~ 5C所示,在16例患者中,CTCs均有检出(6 ~ 241个/mL),且明显高于健康人血液中的平均CTCs个数(0.5个/mL)。 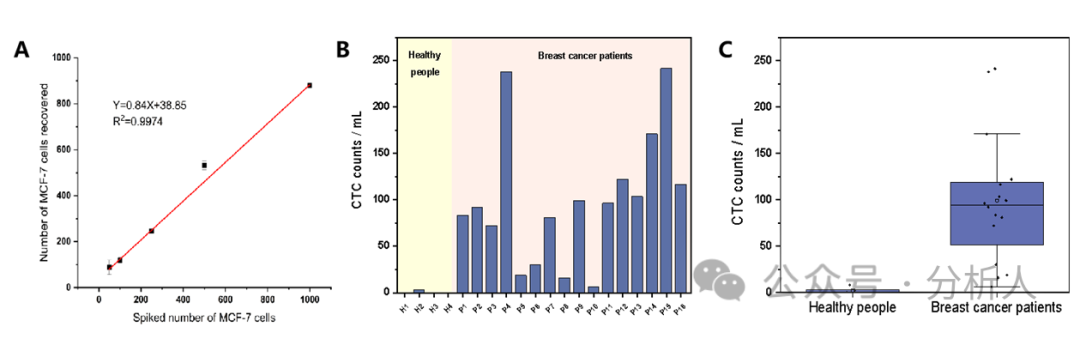 图5 (A)不同数量MCF-7细胞血样加标的ICP-MS检测结果;16例乳腺癌患者和4例健康人1 mL全血中CTCs计数的(B)柱状图和(C)箱形图
图5 (A)不同数量MCF-7细胞血样加标的ICP-MS检测结果;16例乳腺癌患者和4例健康人1 mL全血中CTCs计数的(B)柱状图和(C)箱形图
综上所述,本工作设计了一种基于磁性探针的级联相转移微流控芯片,用于CTCs的分选、纯化和释放,通过ICP-MS测定细胞内源性元素锌(Zn),实现了CTCs细胞的高灵敏度检测。这种微流控芯片设计简单,集成化高,既包含适配体修饰磁性探针介导下的主动分选,又包含螺旋通道和锯齿凹槽引起的被动分选。 此外,在所设计的微流控芯片中,CTCs发生级联相转移,从样品相转移至PBS实现分离和纯化,再转移至核酸酶溶液中实现释放,其CTCs的分选、纯化和释放效率高。在实际血样中,CTCs的加标回收率为84%,白细胞的数量从10⁶数量级减少至100个左右。所建立方法被成功地应用于乳腺癌患者血液样本中CTCs的检测。此外,采用内源性元素标签策略和从细胞表面温和去除磁性探针显著提高了细胞活力,回收的细胞活性高达99.3%。综上所述,所构建的方法在癌症的早期诊断、肿瘤进展监测和肿瘤预后评估等临床应用方面表现出巨大的应用潜力。
审核编辑:刘清







